
发表时间:2019/12/11 责任编辑:中旭
长久以来,骨骼研究学者们也一直聚焦于骨髓微环境的干细胞分化“事件”:间充质干细胞分化的成骨细胞和造血干细胞由来的破骨细胞所介导的骨代谢平衡。然而,相比较于研究透彻的造血干细胞系统,间充质干细胞特别是成骨干细胞的鉴定和分化研究,一直以来仍处于相对空白或滞后的状态,成为了深入骨骼和相关疾病研究的“瓶颈”。
近年来,随着单细胞测序技术和共聚焦显微成像的发展和运用,髓内间充质干细胞的鉴定和功能解析逐渐成为学科内新的研究热点。2015年, 斯坦福大学Michael T. Longaker研究团队首次在Cell杂志上发文【1】,系统性阐明了小鼠骨骼干细胞的富集策略和“干”性鉴定,解决了困扰学术界以久的成骨干细胞的定义问题。同期,哥伦比亚大学的Timothy C. Wang团队也于Cell报道了Gremlin1 标记的骨骼干细胞的分化潜能【2】。这两项背靠背的研究吹响了骨骼干细胞研究的号角。近期,Michael T. Longaker课题组更是开创性地鉴定了人类骨骼干细胞及其分化的等级关系【3】(Cell突破丨人类骨骼干细胞终于被鉴定出来),为骨骼疾病的精准治疗奠定了分子遗传和发育的理论基础,预示着一场硬组织干细胞的研究“风暴”即将来临。
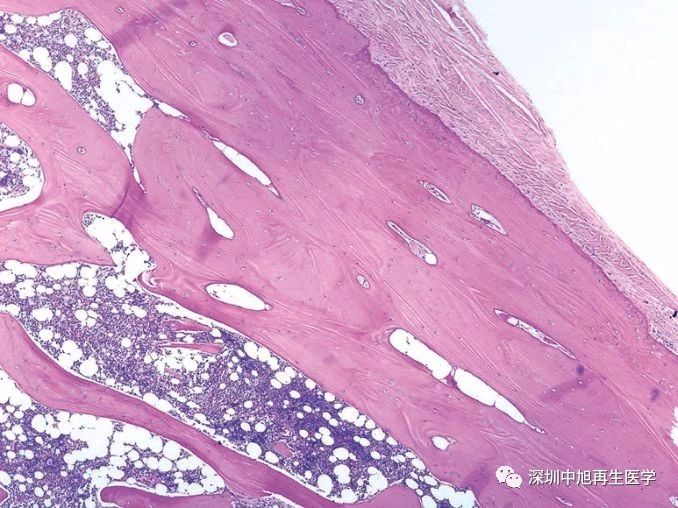
经典骨骼形态解剖学
经典骨骼形态解剖学显示骨骼系统被皮质骨天然隔离成骨腔内环境和骨膜外环境(如图一)。然而,长久以来,骨生物学家们一直专注于髓内多能干细胞的功能和临床运用,却忽略了骨膜潜在的干细胞属性。试验和临床上的大量数据表明,骨骼系统的发育和再生与其包被的骨膜有着千丝万缕的联系, 例如骨折的愈合和促骨形成药物的响应等。既然骨膜的功能在生理和病理条件下都如此重要,那么骨膜中的成骨干细胞是否存在?如果存在,它的分化等级和功能又是如何呢?其实早在2013年,布朗大学的Wentian Yang研究团队就已经在Nature发文证实,在关节软骨外膜旁的兰氏结构处(perichondrial groove of Ranvier),存在着一些cathepsin K阳性的 类似间质干细胞的分布【4】。文章进一步显示在小鼠的cathepsin K阳性细胞中,敲除Ptpn11会导致内生软骨瘤的形成,潜在证明了cathepsin K不仅仅标记成熟的破骨细胞而且很有可能标记骨膜中的成骨前体细胞或干细胞。
近日,研究人员在《Cell Stem Cell》杂志上发表的一项研究揭示了一种新的分子机制,或许有助于成年骨骼的维护和修复,并为开发改善骨骼愈合的治疗策略提供了可能性。
“成人骨骼的修复依赖于骨干细胞的活化,而我们对骨骼干细胞的特征仍然缺乏了解。骨髓内以及骨膜周围的骨膜(组织的外层)中都有干细胞的发现。而且以前的研究表明,这两个干细胞群虽然具有许多相同的特征,但仍存在独特的功能和特定的调节机制。”
目前我们对骨膜干细胞了解最少。众所周知,它们由异质性的细胞组成,并且可以促进骨骼增厚,形状生成和骨折修复,但是科学家们无法区分不同类型的骨干细胞来研究如何调节其不同功能。
在当前的研究中,Park和他的同事们开发了一种方法来识别骨膜干细胞的不同亚群,确定它们在活小鼠模型中对骨折修复的作用,并确定在生理条件下调节其迁移和增殖的特定因素。
研究人员在小鼠模型中发现了骨膜干细胞的特定标记,从而鉴定出干细胞的独特亚群,该亚群有助于成年骨骼的再生。“我们还发现骨膜干细胞通过参与骨骼愈合来对机械损伤作出反应。这一过程对于治愈成年小鼠的骨折非常重要,而且骨膜干细胞对骨骼再生的贡献高于骨髓干细胞。”
此外,研究人员发现,骨膜干细胞还能够对趋化因子CCL5有反应。骨膜干细胞表面受体与CCL5结合,进而引起干细胞向受伤的骨头部位迁移并对其进行修复。在小鼠模型中删除CCL5基因会导致骨骼修复中明显的缺陷或愈合时间的延长。当研究人员向缺乏CCL5的小鼠认为提供CCL5时,骨愈合过程得以加速。
这些发现提示了潜在的治疗应用价值。例如,在患有糖尿病或骨质疏松症的人中,骨愈合相对缓慢,并且可能由于活动受限而导致其他并发症的发生。因此,加速骨愈合可以减少住院时间并改善预后。
资讯出处:New bone healing mechanism has potential therapeutic applications
原始出处:Laura C. Ortinau, Hamilton Wang, Kevin Lei, Lorenzo Deveza, Youngjae Jeong, Yannis Hara, Ingo Grafe, Scott B. Rosenfeld, Dongjun Lee, Brendan Lee, David T. Scadden, Dongsu Park. Identification of Functionally Distinct Mx1 αSMA Periosteal Skeletal Stem Cells. Cell Stem Cell, 2019; 25 (6): 784 DOI: 10.1016/j.stem.2019.11.003
参考文献:
1、Chan, C. K., Seo, E. Y., Chen, J. Y., Lo, D., McArdle, A., Sinha, R., ... & Lu, W. J. (2015). Identification and specification of the mouse skeletal stem cell. Cell, 160(1), 285-298.
2、Worthley, D. L., Churchill, M., Compton, J. T., Tailor, Y., Rao, M., Si, Y., ... & Gross, S. (2015). Gremlin 1 identifies a skeletal stem cell with bone, cartilage, and reticular stromal potential. Cell, 160(1), 269-284.
3、Chan, C. K., Gulati, G. S., Sinha, R., Tompkins, J. V., Lopez, M., Carter, A. C., ... & Brewer, R. E. (2018). Identification of the Human Skeletal Stem Cell. Cell, 175(1), 43-56.
4、Yang, W., Wang, J., Moore, D. C., Liang, H., Dooner, M., Wu, Q., ... & Neel, B. G. (2013). Ptpn11 deletion in a novel progenitor causes metachondromatosis by inducing hedgehog signalling. Nature, 499(7459), 491.
2025/09/11
2025/04/06
2025/03/11
2024/12/26
2024/11/05
2024/11/30
2024/12/03
2022/07/28
2023/03/04
2021/11/26